Vì sao bảng tuần hoàn có ý nghĩa quan trọng ✅ Đầy đủ
Mẹo về Vì sao bảng tuần hoàn có ý nghĩa quan trọng Chi Tiết
Bùi Phương Thảo đang tìm kiếm từ khóa Vì sao bảng tuần hoàn có ý nghĩa quan trọng được Update vào lúc : 2022-09-14 02:50:38 . Với phương châm chia sẻ Bí kíp về trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi đọc nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Mình lý giải và hướng dẫn lại nha.Bảng tuần hoàn những nguyên tố hóa học là một trong những lượng kiến thức và kỹ năng cơ bản phải được dạy để hoàn toàn có thể học môn Hóa học. Hãy cùng Bamboo tìm hiểu bảng tuần hoàn những nguyên tố hóa học cùng những thông tin rõ ràng nhé!
Bảng tuần hoàn những nguyên tố hóa học là lượng kiến thức và kỹ năng cơ bản ngay từ đầu phải được dạy để hoàn toàn có thể học môn Hóa học. Được xem như thể những kiến thức và kỹ năng nền tảng khởi xướng cho môn hóa học, từ đó mới hoàn toàn có thể tiếp thu những phản ứng hóa học, những nguyên tố mới, những biến hóa đầy thú vị.
Bảng tuần hoàn những nguyên tố hóa học là phương pháp hiển thị theo dạng bảng những nguyên tố hóa học do nhà hóa học người Nga Dmitri Mendeleev phát minh vào năm 1869. Theo thời gian bố cục của bảng tuần hoàn những nguyên tố hóa học đã được sửa đổi và mở rộng dần khi những nguyên tố mới dần được phát hiện ra.
Giá trị nòng cốt của bảng tuần hoàn những nguyên tố hóa học là kĩ năng tính toán tính chất hóa học của một nguyên tố nhờ vào vị trí của nó trên bảng tuần hoàn những nguyên tố hóa học từ đó biết được thuộc tính theo chiều dọc hoặc theo chiều ngang.

Dựa vào vị trí của những nguyên tố trong bảng tuần hoàn những nguyên tố hóa học, tất cả chúng ta hoàn toàn có thể xác định được những thông tin thiết yếu như sau:
- Các nguyên tố nhóm IA, IIA và IIIA (trừ Bo và Hidro) có tính sắt kẽm kim loại. Nhóm VA, VIA và VIIA có tính phi kim (trừ Antimon, Bitmut và Poloni).
Vị trí nguyên tố xác định được hóa trị cao nhất của nguyên tố đó với Oxi và Hidro.
Xác định được công thức oxit cao nhất cũng như hidroxit tương ứng.
Công thức hợp chất với Hidro,…
Ta hoàn toàn có thể địa thế căn cứ vào những mối quan sau để xác định được những thông tin trên:
- Vị trí của nguyên tố và đặc điểm về cấu trúc nguyên tử
Vị trí của nguyên tố và tính chất của nó
Một thông tin khác được thu thập nhờ vào bảng nguyên tố hóa học đó đó đó là nhờ vào những quy luật trong chu kỳ luân hồi và nhóm, hoàn toàn có thể tiến hành so sánh những tính chất hóa học của nguyên tố đó tại vị trí đó với những nguyên tố lân cận.

Dưới đây là bảng tuần hoàn những nguyên tố hóa học lớp 8,9,10 đầy đủ nhất đáng tham khảo:

Hãy cùng Bamboo tìm hiểu sâu hơn cấu trúc của bảng tuần hoàn hóa học nhé qua những thông tin của mỗi nguyên tố nhé!
Với mỗi nguyên tố chiếm một ô trong bảng tuần hoàn sẽ được gọi là một ô nguyên tố. Với số thứ tự một ô nguyên tố = số hiệu nguyên tử của nguyên tố

Với chu kì thì đây là dãy những nguyên tố mà nguyên tử có cùng số lớp e, được xếp theo chiều tăng dần của điện tích hạt nhân với số thứ tự chu kì = số lớp e.
Ta có bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7, với ý nghĩa sau:
- Chu kì 1, 2, 3: chu kì nhỏ.
Chu kì 4, 5, 6, 7: chu kì lớn.
Chu kì 7 chưa hoàn thành xong.

Với nhóm nguyên tố thì đây là tập hợp những nguyên tố mà nguyên tử có thông số kỹ thuật e tương tự nhau, có tính chất hóa học gần tương tự nhau cũng như được được xếp thành 1 cột.
Có 2 loại nhóm nguyên tố đó là nhóm A và nhóm B:
- Nhóm A: Nhóm này gồm có những nguyên tố s và p với số thứ tự nhóm A = tổng số e lớp ngoài cùng
Nhóm B: Nhóm này gồm có những nguyên tố d và f có thông số kỹ thuật e nguyên tử tận cùng ở dạng (n – 1)dxnsy:
- Nếu (x + y) = 3 đến 7 thì đây là nguyên tố thuộc nhóm (x + y)B.
Nếu (x + y) = 8 đến 10 thì đây là nguyên tố thuộc nhóm VIIIB.
Nếu (x + y) to hơn 10 thì đây là nguyên tố thuộc nhóm (x + y – 10)B.

Khối nguyên tố là sự việc phân khối của những nguyên tố trong bảng tuần hoàn, được phân thành 4 khối: khối s, khối p, khối d và khối f.
Với e ở đầu cuối điền vào phân lớp nào thì nguyên tố thuộc khối đó.
Lưu ý: Nguyên tố H được xếp ở hai vị trí là nhóm IA và VIIA đều ở chu kì I. Trong khi nguyên tố He tuy nhiên có 2e lớp ngoài cùng nhưng nằm ở nhóm VIIIA.

Nếu xem bảng tuần hoàn hóa học là một môn nghệ thuật và thẩm mỹ thì những ai đọc được rành mạch xứng đáng là những nghệ sĩ đích thực!
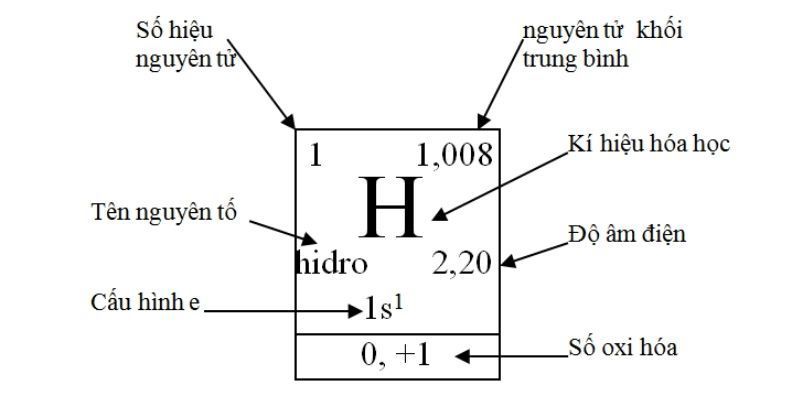
Các nguyên tố trong bảng tuần hoàn hóa học trong một ô sẽ gồm những thành phần thông tin như sau:
Tên nguyên tố: Tên của nguyên tố hóa học được viết bằng từ cổ của tiếng Latin và Hy Lạp. Chúng được phân biệt bằng số hiệu nguyên tử hoặc số proton có trong hạt nhân của mỗi nguyên tử nguyên tố tương ứng.
Ký hiệu hóa học: Đây là chữ viết tắt của tên một nguyên tố. Ký hiệu thông thường có một đến hai vần âm trong bảng vần âm Latin. Chữ cái đầu tiên viết hoa, còn vần âm còn sót lại viết thường.
Số hiệu nguyên tử: Đây là số proton của một nguyên tố có trong trong hạt nhân của một nguyên tử, đây cũng là số điện tích hạt nhân (điện tích dương) của nguyên tử nguyên tố đó. Số hiệu nguyên tử cũng giúp thuận tiện và đơn giản xác định được tên của nguyên tố cần tìm vì mỗi nguyên tố đều có một số trong những hiệu nguyên tử duy nhất.
Lưu ý: Số thứ tự ô nguyên tố = số hiệu nguyên tử = số điện tích hạt nhân
Nguyên tử khối trung bình: Đây là khối lượng trung bình của hỗn hợp những đồng vị của nguyên tố đó tương ứng với một tỷ lệ phần trăm những nguyên tử nhất định.
Độ âm điện: Đây là kĩ năng hút electron của nguyên tử nguyên tố đó để tạo những link hóa học. Độ âm điện càng lớn thì tính phi kim sẽ càng mạnh và ngược lại tính phi kim sẽ nhỏ hay tính sắt kẽm kim loại sẽ mạnh.
Cấu hình electron:Hay còn được gọi là thông số kỹ thuật điện tử, nguyên tử thể hiện sự phân bố những electron có trong lớp vỏ nguyên tử nguyên tố đó ở những trạng thái năng lượng rất khác nhau.
Số oxi hóa: Đây là số electron mà một hay nhiều nguyên tử nguyên tố sẽ trao đổi với nguyên tử nguyên tố khác khi bước vào vào một phản ứng oxi hóa khử.
Định nghĩa
Đây là một dãy những nguyên tố hóa học có cùng số lớp e được sắp xếp theo chiều tăng dần điện tích hạt nhân.
Phân loại chu kỳ luân hồi
Gồm có 7 chu kỳ luân hồi:
- Chu kỳ 1, 2 và 3 được xem là chu kỳ luân hồi nhỏ.
Chu kỳ 4,5,6 và 7 được xem là chu kỳ luân hồi lớn. Chu kỳ 7 đến nay vẫn không được hoàn thiện.
Trong số đó:
- Chu kỳ 1: Có 2 nguyên tố là Hidro ( Z=1) và Heli (Z=2).
Chu kỳ 2: Có 8 nguyên tố từ Liti (Z=3) đến Neon (Z=10).
Chu kỳ 3: Có 8 nguyên tố từ Natri (Z=11) đến Argon (Z=18).
Chu kỳ 4: Có 18 nguyên tố từ Kali (Z=19) đến Krypton (Z=36).
Chu kỳ 5: Có 18 nguyên tố từ Rubidi (Z=37) đến Xenon (Z=54).
Chu kỳ 6: Có 32 nguyên tố từ Xesi (Z=55) đến Ranon (Z=86).
Chu kỳ 7: Bắt đầu từ nguyên tố Franxi (Z=87) đến nguyên tố Z=110.
Tính chất chu kỳ luân hồi
Các nguyên tố cùng một chu kỳ luân hồi sẽ có số lớp electron bằng nhau cũng như bằng số thứ tự chu kỳ luân hồi. Một chu kỳ luân hồi thông thường sẽ khởi đầu từ một sắt kẽm kim loại kiềm và kết thúc bằng một nguyên tố khí hiếm.
Hai hàng cuối của bảng tuần hoàn hóa học là hai họ nguyên tố mà có thông số kỹ thuật e đặc biệt là: Họ Latan gồm có 14 nguyên tố thuộc chu kỳ luân hồi 6 và họ Actini gồm có 14 nguyên tố thuộc chu kỳ luân hồi 7.

Định nghĩa
Nhóm nguyên tố hay gọi ngắn gọn là nhóm, là tập hợp tất cả những nguyên tố có thông số kỹ thuật electron tương tự như nhau, do đó tính chất hóa học gần như thể giống nhau, xếp thành một cột, và được gọi chung là một nhóm.
Phân loại nhóm nguyên tố
Có 8 nhóm A và 8 nhóm B (riêng nhóm VIIIB gồm 3 cột).
Nhóm A: Gồm nguyên tố nhóm s và nguyên tố nhóm p. Có số thứ tự nhóm bằng với số lớp e ngoài cùng.
Nhóm B: Gồm những nguyên tố nhóm d và nhóm f. Có thông số kỹ thuật e ngoài cùng ở dạng (n-1)dxnsy. Khi đó, cách xác định nhóm của những nguyên tố này sẽ được thực hiện như sau:
- Nếu (x + y) = 3 đến 7 thì đây là nguyên tố thuộc nhóm (x + y)B.
Nếu (x + y) = 8 đến 10 thì đây là nguyên tố thuộc nhóm VIIIB.
Nếu (x + y) to hơn 10 thì đây là nguyên tố thuộc nhóm (x + y – 10)B.

- Các nguyên tố s, p, d, f:
- Nguyên tố s: Bao gồm những nguyên tố nhóm IA và IIA. Có electron ở đầu cuối được điền vào phân nhóm s.
Nguyên tố p: Bao gồm những nguyên tố nhóm IIIA đến nhóm VIIIA (loại trừ Heli). Có electron ở đầu cuối được điền vào phân nhóm p.
Nguyên tố d: Bao gồm những nguyên tố thuộc nhóm B có electron ở đầu cuối được điền vào phân nhóm d.
Nguyên tố f: Bao gồm những nguyên tố thuộc họ Lantan và Actini. Có electron ở đầu cuối được điền vào phân nhóm f.
Làm thế nào để hoàn toàn có thể ghi nhớ nhanh và học hiệu suất cao bảng tuần hoàn những nguyên tố hóa học? Làm sao để hoàn toàn có thể nắm vững kiến thức và kỹ năng hóa học quan trọng này đây? Hãy thử những phương pháp sau cùng Bamboo nhé!

Sẽ rất thuận tiện và đơn giản khi bạn lần lượt học những thành phần của một nguyên tố trong bảng. Một ngày bạn hoàn toàn có thể học từ 5 đến 10 nguyên tố, cứ như vậy cho tới lúc học hết tất cả những nguyên tố có trong bảng.
Đây là cách được áp dụng nhiều cho những môn học rất khác nhau, khi những thông tin có trong bảng tuần hoàn những nguyên tố hóa học thường xuyên được nhìn thấy sẽ giúp não bộ thuận tiện và đơn giản nhận diện và tiếp nhận thông tin hơn, từ đó giúp bạn nhớ lâu, nhớ nhanh những thông tin này.
Học đi đôi với hành, do đó đừng ngại dành thời gian của tớ để thực hành làm những bài tập liên quan đến bảng tuần hoàn những nguyên tố hóa học. Thực hành nhiều lần sẽ giúp bạn nhạy bén hơn trong việc nhận ra những tiềm năng cần xử lý và xử lý với những nguyên tố sau này.
Nếu bạn muốn ghi nhớ thật nhanh những thông tin về bảng tuần hoàn những nguyên tố hóa học thì bạn hãy chia nhỏ những nguyên tố thành những nhóm và đặt tên những nguyên tố đó thành những cụm sao cho bạn dễ nhớ nhất. Và bạn hoàn toàn có thể sáng tác thành những câu “thần chú” cho riêng mình. Ví dụ như vậy này nhé:
Nhóm IA: Hai (H), Li (Li), Nào (Na), Không (K), Rót (Rb), Cà (Cs), Fê (Fr).
Nhóm IIA: Banh (Be), Miệng (Mg), Cá (Ca), Sấu (Sr), Bẻ (Ba), Răng (Ra).
Nhóm IIIA: Bố (B), Ai (Al), Gáy (Ga), Inh (In), Tai (Ti).
Nhóm IV: Chú (C), Sỉ (Si), Gọi em (Ge), Sang nhắm (Sn), Phở bò (Pb).
Nhóm V: Nhà (N), Phương (P), Ăn (As), Sống (Sb), Bí (Bi).
Nhóm VI: Ông (O), Say (S), Sỉn (Se), Té (Te), Pò (Po).
Nhóm VII: Phải (F), Chi (Cl), Bé (Br), Yêu (I), Anh (At).
Nhóm VIII: Hằng (He), Nga (Ne), Ăn (Ar), Khúc (Kr), Xương (Xe), Rồng (Rn)
 Tải thêm tài liệu liên quan đến nội dung bài viết Vì sao bảng tuần hoàn có ý nghĩa quan trọng
Hỏi Đáp
Vì sao
Tải thêm tài liệu liên quan đến nội dung bài viết Vì sao bảng tuần hoàn có ý nghĩa quan trọng
Hỏi Đáp
Vì sao
